Как продлить быстротечную жизнь.
Структура молекул воды.
Свойства молекул в основном определяются типом связей между атомами в молекуле и молекулярной «архитектурой». Под «архитектурой» следует понимать структуру молекулы – ее форму.
Как известно, химические свойства любого атома зависят от его ядра, протоны которого несут положительный заряд и вместе с нейтронами определяют атомный вес. А легкие, отрицательно заряженные электроны, движущиеся вокруг ядер, являются теми частицами, которые активно участвуют в химических реакциях.
Если нейтральный атом теряет электроны со своей наружной оболочки, он становится положительным ионом, а если приобретает электроны, то становится отрицательным ионом.
Вследствие электростатического взаимодействия (по закону Кулона) такие ионы с противоположными зарядами притягиваются, и эта соединяющая их сила называется ионной связью. Этой связью, например, соединяются атомы натрия с атомами хлора в кристаллах хлорида натрия (поваренной соли).
Здесь следует коснуться еще той части квантовой механики, которая известна как принцип исключения Паули и которая объясняет нам, почему электроны не свободны в своем движении и не могут располагаться вокруг ядра беспорядочно. Они должны размещаться в строго определенном порядке. У атома может быть лишь определенное число оболочек, и на каждой оболочке может находиться лишь определенное число электронов. Если у атома больше электронов, чем могут вместить первые прилегающие к ядру оболочки, то эти электроны должны занять новую, еще не заполненную оболочку дальше от ядра. С другой стороны, если у атома имеется точно такое количество электронов, какое необходимо, чтобы заполнить одну или несколько оболочек, и сверх этого нет ни одного лишнего электрона, то такой атом достигает устойчивого состояния. Он химически инертен. Таким свойством обладают инертные газы. Периодическая таблица элементов показывает, что, если атомы имеют 2, 10, 18, 36, 54 и 86 электронов (а это все инертные газы), они очень устойчивы. Они «отказываются» от всех предложений взаимодействовать с другими атомами.
Атомы активных элементов, не имеющие набора электронов, свойственных инертным газам, стремятся достичь устойчивости инертных газов, либо приобретая новые электроны, либо освобождаясь от лишних. В качестве примера опять рассмотрим хлорид натрия. Третий период в периодической таблице элементов начинается с натрия и кончается инертным газом аргоном. У натрия полностью заполнены первая и вторая оболочки (2 и 8), а на третьей находится только один электрон. Поэтому натрий легко отдает этот один электрон на внешней оболочке и приобретает устойчивость инертного газа неона. А хлор тоже находится в третьем периоде, но у него на третьей оболочке находится не один, как у натрия, а 7 электронов, поэтому ему более свойственно не сбросить эти 7 электронов, а присоединить всего лишь один и таким образом приобрести устойчивость инертного газа аргона (2, 8 и 8 электронов). Так и образуется хлорид натрия – натрий отдает один электрон и становится ионом со знаком плюс (+), а хлор присоединяет один электрон и становится ионом со знаком минус (-). И в результате ионного взаимодействия между этими ионами получается устойчивая молекула поваренной соли.
Теперь посмотрим с этой же позиции (с позиции устойчивости атома) на атомы водорода и кислорода. Водород находится в первом периоде периодической таблицы и имеет всего один электрон. А второй элемент этого периода – гелий – имеет два электрона (то есть первая оболочка у него полностью заполнена), и в результате – это химически инертный газ. А водород – химически активный газ. Он не может стать похожим на гелий путем присоединения второго электрона (отрицательного иона водорода никто еще не обнаруживал), так как у него мал заряд. Но для этого (чтобы стать подобным гелию) у него имеется другой путь (об этом чуть ниже).
Второй период таблицы Менделеева заканчивается инертным газом неоном, у которого полностью заполнены электронами первая и вторая оболочки (2 и 8). В этом же периоде находится и кислород, которому недостает двух электронов для полного заполнения второй оболочки, чтобы стать устойчивым, подобно неону. Поэтому кислород и является сильным окислителем – он всегда стремится присоединить на свою вторую оболочку еще два электрона (окислителем называется то вещество, которое в ходе реакции принимает электроны). И если в какой-то момент к атому кислорода приблизится атом водорода (при высокой температуре), может произойти обобщение электронов атомов кислорода и водорода, то есть электрон, принадлежащий водороду, может начать двигаться по орбите и вокруг ядра атома водорода, и вокруг ядра атома кислорода. Одновременно и точно так же один электрон, принадлежащий кислороду, тоже начнет вращаться вокруг ядер и кислорода, и водорода, обеспечивая связь между этими ядрами. Такая связь, образованная парой электронов, находящихся в общем «пользовании» у двух атомов, называется ковалентной связью (приставка «ко» в слове «ковалентная» обозначает совместное участие и соответствует приставке «со» в русских словах, как, например, в словах «сотрудник», «соавтор», в итоге слово «ковалентная» означает «объединенная»). Ковалентная связь настолько широко распространена среди химических веществ, что иногда ее просто называют химической связью. Здесь же следует отметить, что в данном случае для нас наиболее важным положением квантово-механической теории является то, что движение электронов происходит по «разрешенным» орбитам. А понятие орбита означает пространственное описание движения электрона, соответствующее определенному устойчивому состоянию.
Продолжим рассматривать процесс образования молекулы воды. После присоединения одного атома водорода к кислороду у последнего до полного заполнения второй оболочки недостает всего одного электрона, чтобы получилась устойчивая структура по образцу инертного газа неона. Поэтому кислород присоединяет с помощью ковалентной связи еще один атом водорода, и в результате образуется молекула воды. Очень устойчивая молекула (и не так-то легко ее разрушить, поэтому долгое время – вплоть до XVIII века – вода считалась простым веществом), так как и у кислорода полностью заполнены электронами обе оболочки, и у атомов водорода первая (и единственная) оболочка тоже полностью заполнена двумя электронами. И каждый из атомов водорода в молекуле воды становится подобным атому гелия.
Так мы восстановили в своей памяти сведения об ионной и ковалентной связях, а теперь нам предстоит выяснить физическую сущность еще одной связи – водородной.
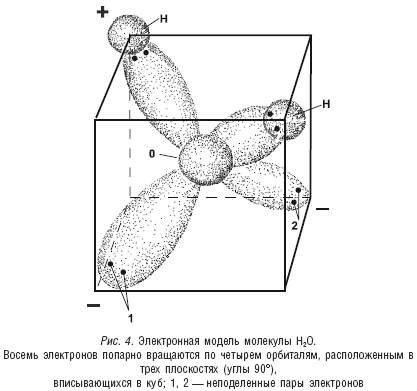
Вокруг ядра атома кислорода в молекуле воды на второй оболочке вращаются восемь электронов. Но, согласно той же квантовой механике, все эти электроны не создают какую-то общую сферу, а вращаются только попарно по четырем обособленным орбитам или орбиталям. По двум орбитам вращаются две пары электронов, которые взаимодействуют только с ядром кислорода (так называемые неподеленные пары электронов). А по двум другим орбитам также движутся по два электрона, «обслуживающие» уже и атом водорода, и атом кислорода, и находящиеся, таким образом, уже в «совместном пользовании», которые и создают ковалентную связь между двумя атомами водорода и атомом кислорода. Электронные пары, образующие ковалентную связь, смещены к ядру кислорода и немного удалены от ядер водорода. Это ведет к тому, что оба атома водорода приобретают некоторый положительный заряд. Эти же электронные пары оказывают влияние и на орбиты неподеленных пар электронов, принуждая их несимметрично удлиняться, что создает повышенную плотность электронного облака на удаленном от ядра кислорода участке орбиты, а это равноценно некоему отрицательному заряду в этом месте (см. рис. 4).
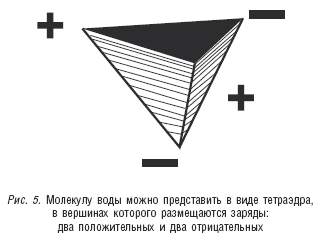
В итоге молекулу воды можно рассматривать как треугольную пирамиду тетраэдрического типа, в вершинах которой размещаются четыре заряда: два положительных и два отрицательных (см. рис. 5).
Такое распределение зарядов превращает молекулу воды в диполь. Кроме того, положительный заряд слабо экранированного ядра атома водорода притягивает отрицательный заряд электроотрицательного атома кислорода второй молекулы воды. Это притяжение примерно в 20 раз слабее, чем ковалентная связь, которая удерживает атом водорода около атома кислорода в первой молекуле воды, однако это достаточно сильное взаимодействие между двумя молекулами воды (структура льда построена только на таких связях, но об этом будет сказано ниже). Атом водорода в данном случае служит мостиком между двумя атомами кислорода, причем с одним из них он связан ковалентной связью, а с другим – электростатическими силами взаимодействия. Такая связь называется водородной. И если ковалентные связи мы изображаем прямыми линиями, то водородные – точечными, подчеркивая этим, что они гораздо слабее первых.
Так изображается водородная связь между двумя молекулами воды:
Н – О – Н ··· О <
Молекула воды может иметь четыре водородные связи, но между двумя атомами кислорода всегда находится только один атом водорода.
Жидкости, молекулы которых удерживаются вместе водородными связями, называют ассоциированными (объединенными) жидкостями. К таким жидкостям относится и вода. Водородные связи обусловливают необычайную силу сцепления воды, проявляющуюся и в ее высоком поверхностном натяжении. Высокая температура кипения воды также обусловлена большой энергией, необходимой для разрушения (или для разрыва) водородных связей. Поскольку все эти свойства воды имеют в буквальном смысле слова жизненное значение для растений и животных и поскольку эти свойства зависят от водородных связей, то эти связи можно смело назвать жизненными связями в таком же смысле, как ковалентные связи часто называют просто химическими связями.
Водородные связи образуются лишь с немногими элементами периодической таблицы – с кислородом, фтором, азотом и изредка с хлором. И объясняется это большой разностью между электроотрицательностью водорода и электроотрицательностями указанных выше элементов. Электроотрицательность водорода равна 2,2, что намного меньше электроотрицательности азота (3,0), кислорода (3,4) или фтора (4,0). По этой причине связь между водородом и любым из этих трех элементов обладает довольно высокой полярностью, причем атом водорода всегда находится на положительном конце диполя.
Что это за понятие – электроотрицательность? Электронные пары, обобществляемые двумя различными атомами, не обязательно распределяются между ними поровну, что и было уже показано на молекуле воды. Если один из атомов сильнее притягивает обобществляемые электроны, чем другой, между ними возникает полярная ковалентная связь. Способность атома притягивать к себе электроны, обобществляемые при образовании химической связи, называется его электроотрицательностью.
Водородные связи почти в 20 раз слабее ковалентных, но во много раз сильнее ван-дер-ваальсовых. Впрочем, об этих связях можно говорить и как в меру сильных, и как в меру слабых. Например, на одних только водородных связях построена кристаллическая решетка льда. Все мы знаем, насколько прочен лед. Но стоит немного нагреть лед, как он начнет таять, так как при этом начнут разрушаться водородные связи. Образование льда – это самое наглядное проявление водородных связей. Но эти связи играют чрезвычайно важную роль и в существовании всего живого, они имеются в крови, в белках, в нуклеиновых кислотах и во многих других биополимерах. Например, упорядоченность строения белков не может быть достигнута без участия водородных связей. Белки бывают скручены в спирали, и такую спиралевидную форму обеспечивают водородные связи. В результате нагревания белков (при варке) водородные связи разрываются, и скрученная цепь необратимо теряет свою форму. Водородные связи оказывают влияние и на вязкость крови. При кислой крови величина водородных связей между молекулами воды уменьшается, и кровь (а это в основе своей – вода) становится менее вязкой и, следовательно, более текучей, она легче проникает в микрокапилляры. Такая кровь лучше снабжает клетки нашего организма кислородом. И в быту мы имеем дело с водородными связями; например, при каждой стирке мы пытаемся уменьшить их с помощью поверхностноактивных веществ.
Но самое главное в действиях водородных связей заключается в том, что только благодаря им вода может находиться в жидком состоянии, а следовательно, что возможна сама жизнь. Не вдаваясь в подробности, кратко скажу, что вода имеет столь высокую температуру кипения (100 °C) только потому, что водородные связи удерживают ее молекулы в компактном состоянии (в жидком состоянии). И если бы не было этих связей, любая молекула воды, имея лишь незначительную тепловую энергию, могла бы испариться, и мы имели бы это вещество только в газообразном состоянии.
Но все это пока что всего лишь интересная информация о водородных связях. А теперь мы рассмотрим те явления, связанные с водородными связями, которые непосредственно оказывают влияние на наше здоровье и которыми мы можем хотя бы в некоторой мере управлять.